申請・報告時の提出書類
各種手続きにあたっては、「埼玉医科大学特定臨床研究に関する研究者向けマニュアル」をご覧ください。
特定臨床研究を実施する研究責任医師は、厚生労働大臣に対する定期報告(法第18条関係)を行う義務を有します。
厚生労働大臣への定期報告は、委員会が意見を述べた日から起算して、1ヶ月以内に行わなければなりません。
そして、臨床研究の実施に起因するものと疑われる疾病等が発生した場合は、当該臨床研究の中止その他の必要な措置を講じる必要があります。
① 当該臨床研究を実施する研究責任医師は、当該臨床研究の実施について、下表に基づき、それまでに判明している範囲で報告期間内に第1報を報告する。
※その後速やかに詳細な要因等について続報として報告を行うこととし、当該続報については必ずしも期間内でなくても差し支えない。
② それぞれに定める期間内に実施医療機関の管理者に報告した上で、委員会に報告する。
※状況に応じて報告の順番が前後するのは差し支えない。なお、これらの報告と同時に被験薬の製造販売をし、又はしようとする医薬品等製造販売業者にも情報提供を行う。
③ 当該臨床研究実施者は、委員会の意見を尊重して必要な措置をとる。
一時保存または送信後は登録情報から生成した報告用PDFファイルとXMLファイルがダウンロードできます。
当該臨床研究実施者は、委員会の意見を尊重して必要な措置をとる必要があります。
また中止届を提出した場合であっても、臨床研究が終了するまでの間においては、次の手続きを行ってください。
※主要評価項目報告書の作成を行う場合は、実施計画を変更することにより行ってください。
| 書式 | 必要性 | 備考 | |
| 1 | 審査依頼状【埼玉医科大学書式1】 | 必須 | 統括管理者が署名し、郵送または審査申請システムにて事務局へ提出してください。 |
| 2 | 新規審査依頼書【統一書式2】 | ※ | ※審査申請システムの入力フォームから自動作成されます。 |
| 3 | 実施計画【省令様式第1】 | 必須 |
|
| 4 | 研究計画書 | 必須 | |
| 5 | 説明文書、同意文書 | 必須 | 補償の概要含む(別途作成可) |
| 6 | 実施医療機関の要件【参考書式2-1】 | 研究計画書に記載した場合は不要 | 統括管理者は、当該臨床研究の実施にあたっては設定した要件を満たしていることを確認する必要があります。そのため、次の書類を以って共同研究施設の管理を行ってください(委員会への提出は不要)。 |
| 7 | 履歴書【参考書式4】 | 必須 | 統括管理者のみ委員会への提出を必須としています。 |
| 8 | 研究分担医師リスト【埼玉医科大学書式5】 | 必須 | 統括管理者が作成し委員会に提出してください。多施設共同研究の場合は、実施医療機関ごとに研究責任医師が作成し、統括管理者が委員会に提出してください。
※記載例はこちら |
| 9 |
|
必須 |
※臨床研究法における利益相反管理に関する標準業務手順書ver1.0(厚生労働省) |
| 10 | 契約書写しまたは契約書案 | 必須 | 臨床研究法施行規則第88条(契約で定める事項)が規定する事項が確認できるもの。 |
| 11 | 統括管理者の研究倫理教育の受講証 | 必須 | 統括管理者のみ、1)および2)に掲げる受講証明書をご提出ください。
1)研究不正防止に関する教育プログラム(次のいずれか) ①所属機関が実施する研究不正防止に関する教育・研修 ②APRIN eラーニングプログラム ③日本学術振興会研究倫理eラーニングコース(eLCoRE) 2)臨床研究の実施に関する教育プログラム(つぎのいずれか) ①臨床研究中核病院が実施する臨床研究に関する研修 ②2)①に準ずるものであると研究代表(責任)医師が判断した研修 ③ICRwebの次の2つの講座 ・臨床研究の基礎知識講座 ・臨床研究法改正と治験・臨床研究情報の公開について |
| 12 | 疾病等が発生した場合の手順書 | 研究計画書に記載した場合は不要 | 臨床研究法では特定臨床研究の実施に起因するものと疑われる疾病等を知った場合、厚生労働大臣に報告することが義務付けられています。疾病等が発生した場合の手順書を作成するにあたっては、次の資料を参考にしてください。
※臨床研究に基づく疾病等報告(医療従事者向け):独立行政法人医薬品医療機器総合機構 |
| 13 | モニタリング手順書 | 研究計画書に記載した場合は不要 | |
| 14 | 監査手順書 | 作成した場合 | |
| 15 | 統計解析計画書 | 作成した場合 | |
| 16 | 医薬品等の概要を記した資料 | 作成した場合 | |
| 17 | 保険の加入状況が分かる書類 | 必須 | 保険証書若しくは見積書等の写しをご提出ください(見積書の場合は、研究開始までに保険の契約を締結し、保険証書等の写しを提出すること)。 |
| 18 | その他、委員会が求める書類 | ― |
委員会から「継続審査」の審査結果通知書を受領し、その指摘事項に対応するにあたっては、以下の書類を作成してください。
| 書式 | 備考 | |
| 1 | 新規審査依頼書【統一書式2】 |
|
| 2 | 変更点一覧【埼玉医科大学書式4】 | jRCT登録前であるため、実施計画の変更内容もこの書式に記入してください。
省令様式第2の作成は不要です。 |
| 3 | 変更が生じた書類 | 作成日の更新をして、審査申請システムにアップロードしてください。 |
| 4 | その他、委員会が求める書類 |
実施計画、研究計画書、説明同意文書、利益相反管理基準【様式A】または利益相反管理計画【様式E】、その他委員会で承認された資料に変更が生じる場合には、変更申請を行ってください。
原則として、定例の委員会にて審査を実施します。
※添付する資料の整理番号および実施計画番号(jRCT番号)の記載漏れのないようご留意ください。
ただし、以下の事項に関する変更は、委員会の開催を待たず、委員長または副委員長による簡便な審査にて手続きを行います。
なお、提出書類は対面審査、簡便な審査ともに同じです。
原則として、定例の委員会にて審査を実施します。
※添付する資料の整理番号および実施計画番号(jRCT番号)の記載漏れのないようご留意ください。
| 書式 | 必要性 | 備考 | |
| 1 | 審査依頼状【埼玉医科大学書式1】 | 変更がある場合 | 初回提出時から、審査依頼状の記載内容に変更が生じた場合のみ提出してください。 |
| 2 | 変更審査依頼書【統一書式3】 | 必須 |
|
| 3 | 実施計画事項変更届書【省令様式第2】 | 変更がある場合 | jRCT上で作成し、一時保存したデータ(PDFファイル)を提出してください。 |
| 4 | 実施計画【省令様式第1】 | 変更がある場合 | jRCT上で作成し、一時保存したデータ(PDFファイル)を提出してください。 |
| 5 | 変更点一覧【埼玉医科大学書式4】 | 必須 | 変更が生じた箇所は赤字にしてください。 |
| 変更が生じた書類 | 必須 | ①統括管理者に変更が生じる場合、原則すべての書類を提出してください。
②統括管理者、研究責任医師、研究分担医師に変更が生じる場合、次の書類をご提出ください。 ・研究分担医師リスト【埼玉医科大学書式5】※記載例はこちら ・利益相反管理基準【様式A】 ・利益相反管理計画【様式E】※利益相反の書式はこちら ・参加施設一覧など変更が及ぶもの |
|
| 6 | その他、委員会が求める書類 | ― |
なお、提出書類は対面審査、簡便な審査ともに同じです。
- 次に掲げる研究分担医師に関する変更
・研究分担医師の追加(利益相反管理計画(様式E)で申告すべき個人的利益相反がない場合に限る)
・研究分担医師の削除 - 委員会で承認を得る条件が明示的かつ具体的に指示された上で継続審査となった場合であって、当該指示の内容と異ならないことが明らかである変更
実施計画に次に掲げる変更のみが生じる場合には、jRCTにて「軽微変更の届出」を行うとともに、委員会へ軽微変更通知を行ってください。
- 特定臨床研究に従事する者の氏名、連絡先又は所属する機関の名称の変更であって、当該者又は当該者の所属する機関の変更を伴わないもの
・統括管理者の連絡先
・統計解析担当者
・統計解析担当機関
・統括管理者、研究責任医師以外の研究を統括する者 - 地域の名称の変更又は地番の変更に伴う変更
- 苦情及び問い合わせを受け付けるための窓口の変更(研究に関する問い合わせ先)
- 研究責任医師又は研究代表医師の所属する実施医療機関の管理者の氏名の変更
- 特定臨床研究の実施の可否についての管理者の承認に伴う変更
- 特定臨床研究の実施状況の確認に関する事項であって、当該特定臨床研究の結果及び監査の実施の変更を伴わないもの
・症例登録開始予定日
・第1症例登録日
・進捗状況 - 審査意見業務を行う認定臨床審査委員会の名称又は連絡先の変更であって、当該認定臨床研究審査委員会の変更を伴わないもの
・委員会の名称、住所、電話番号、電子メールアドレス - 上に掲げる変更のほか、特定臨床研究の実施の適否及び実施に当たって留意すべき事項に影響を与えないものとして、厚生労働省医政局長が定めるもの
・他の臨床研究登録機関発行の研究番号
・他の臨床研究登録機関の名称
・その他
| 書式 | 備考 | |
| 1 | 軽微変更通知書【統一書式14】 | 審査申請システムの入力フォームから自動作成されます。 |
| 2 | 実施計画事項軽微変更届書【省令様式第3】 | jRCT上で作成したデータ(PDFファイル)を提出してください。 |
| 3 | 実施計画【省令様式第1】 | jRCT上で作成したデータ(PDFファイル)を提出してください。 |
| 4 | その他、委員会が求める書類 |
事前確認不要事項とは、それに該当する事項を、承認を決定するプロセスとして委員会が業務規程に位置付けることで、
委員会審査をせずとも包括的に審査意見業務を行ったとみなすものです。
本委員会では、以下に定める事項を事前確認不要事項とします。
委員会審査をせずとも包括的に審査意見業務を行ったとみなすものです。
本委員会では、以下に定める事項を事前確認不要事項とします。
- 進捗状況の変更
- 契約書有無の記載変更及び契約締結日の追加
- e-Rad番号の変更
- 研究内容の変更を伴わないことが明らかである誤記の修正または記載整備
- 委員会審査後の公開先であるjRCTシステム上の変更があり、実施計画の一部表記、項目に変更が生じた際の追記・修正事項
- 関東信越厚生局の差し戻しによる指摘に対応した修正事項
| 書式 | 必要性 | 備考 | |
| 1 | 変更審査依頼書【統一書式3】 | 必須 |
|
| 2 | 実施計画事項変更届書【省令様式第2】 | 変更がある場合 | jRCT上で作成し、一時保存したデータ(PDFファイル)を提出してください。 |
| 3 | 実施計画【省令様式第1】 | 変更がある場合 | jRCT上で作成し、一時保存したデータ(PDFファイル)を提出してください。 |
| 4 | 変更点一覧【埼玉医科大学書式4】 | 必須 | 変更が生じた箇所は赤字にしてください。 |
| 5 | 変更が生じた書類 | 変更がある場合 | |
| 6 | その他、委員会が求める書類 | ― |
委員会への定期報告
委員会は、定期報告を受けた場合には、当該臨床研究の継続の適否について意見を述べます。特定臨床研究を実施する研究責任医師は、厚生労働大臣に対する定期報告(法第18条関係)を行う義務を有します。
厚生労働大臣への定期報告は、委員会が意見を述べた日から起算して、1ヶ月以内に行わなければなりません。
提出するもの
- 委員会宛ての定期報告書【統一書式5】※審査申請システムの入力フォームから自動作成。書式添付も可。
- 地方厚生局宛ての定期報告書【別紙様式3】 ※jRCT上で作成し、一時保存したデータ(PDFファイル)を提出してください。
- 研究分担医師リスト【本学書式5】
- 利益相反管理計画【様式E】
※様式CおよびDを作成し、変更が生じた場合に提出すること
※書式はこちら
報告時期
- 実施計画を厚生労働大臣に提出した日から起算して、1年ごと、当該期間満了後2ヶ月以内
厚生労働大臣への定期報告
提出するもの
- 地方厚生局宛ての定期報告書【別紙様式3】 ※jRCT上で作成・提出してください。
報告事項
- 当該臨床研究の実施計画に記載されている認定臨床研究審査委員会の名称
- 当該認定臨床研究審査委員会による当該臨床研究の継続の適否及び委員会に報告した事項について
報告期日
委員会が意見を述べた日から起算して、1ヶ月以内委員会への疾病等報告
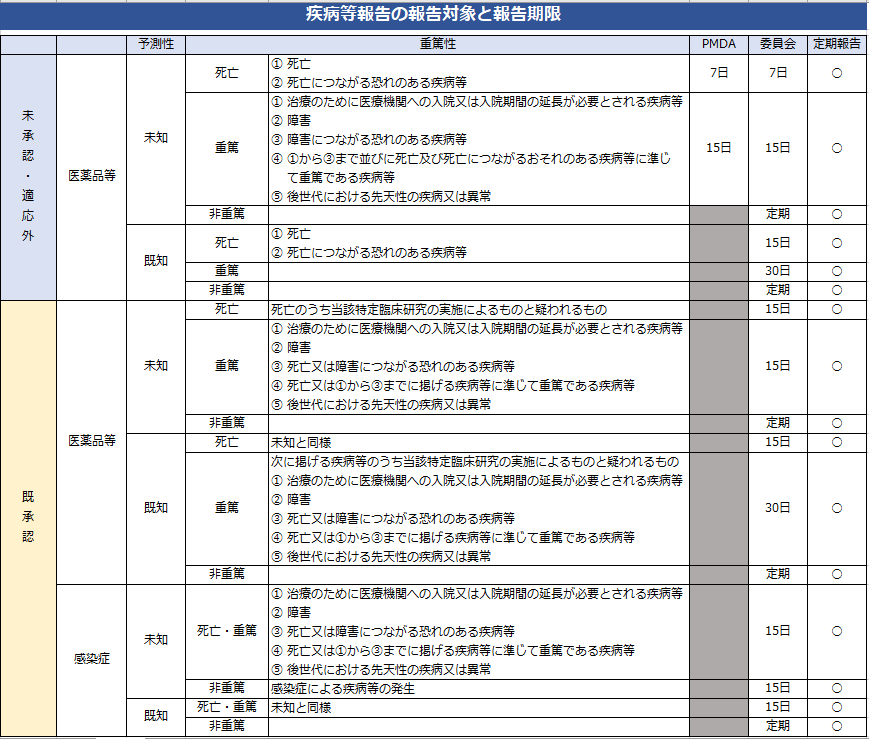
統括管理者は、疾病等が発生した場合の手順書に沿った対応を行ってください。そして、臨床研究の実施に起因するものと疑われる疾病等が発生した場合は、当該臨床研究の中止その他の必要な措置を講じる必要があります。
① 当該臨床研究を実施する研究責任医師は、当該臨床研究の実施について、下表に基づき、それまでに判明している範囲で報告期間内に第1報を報告する。
※その後速やかに詳細な要因等について続報として報告を行うこととし、当該続報については必ずしも期間内でなくても差し支えない。
② それぞれに定める期間内に実施医療機関の管理者に報告した上で、委員会に報告する。
※状況に応じて報告の順番が前後するのは差し支えない。なお、これらの報告と同時に被験薬の製造販売をし、又はしようとする医薬品等製造販売業者にも情報提供を行う。
③ 当該臨床研究実施者は、委員会の意見を尊重して必要な措置をとる。
提出するもの
- 医薬品の疾病等報告書【統一書式8】
※審査申請システムの入力フォームから自動作成。書式添付も可。 - 詳細記載用書式
- 疾病等報告書(医薬品)【別紙様式第2-1】※未承認・適応外医薬品等の予期できない死亡または重篤な疾病等の場合
※jRCT上で作成し、一時保存またはPMDA送信後の登録情報から生成した報告用データ(PDFファイル)を提出してください。 - 必要に応じて、検査値等の臨床データの写し

厚生労働大臣への疾病等報告
統括管理者は、特定臨床研究の実施について、上記の表に基づき、それぞれに定める期間内に厚生労働大臣に報告を行ってください。jRCT上で疾病等報告書(医薬品)【別紙様式第2-1】を作成し「PMDAにメール送信」ボタンを押下することで、自動的に厚生労働大臣(医薬品医療機器総合機構)に送信されます。一時保存または送信後は登録情報から生成した報告用PDFファイルとXMLファイルがダウンロードできます。
提出するもの
医薬品の臨床研究の疾病等報告の場合
- 疾病等報告書(医薬品)【別紙様式第2-1】※jRCT上で作成してください。
- 必要に応じて、検査値等の臨床データの写し
医療機器の臨床研究の疾病等報告の場合
- 疾病等報告書(医療機器)【別紙様式第2-2】※jRCT上で作成してください。
- 必要に応じて、検査値等の臨床データの写し
不具合報告
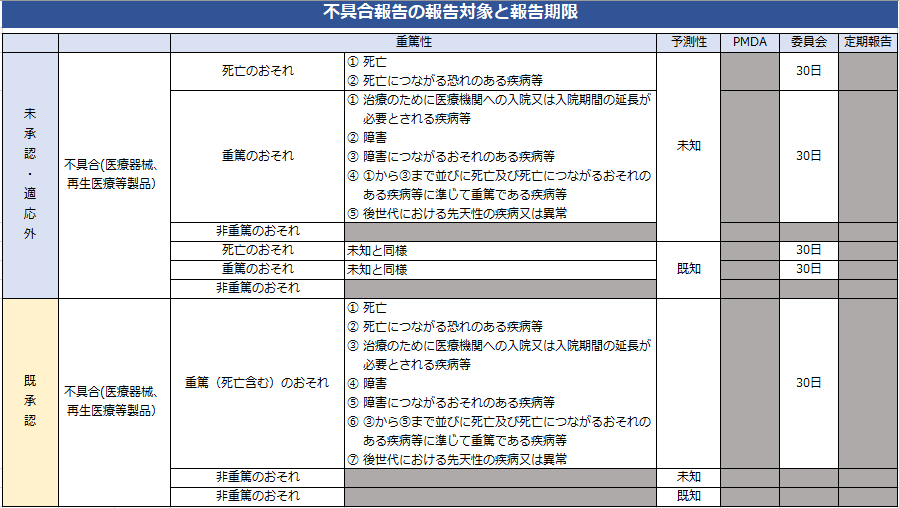
研究代表(責任)医師は、実施計画に記載された当該臨床研究の実施について、当該臨床研究に用いる医療機器又は再生医療等製品の不具合の発生であって、当該不具合によって以下の疾病等が発生するおそれのあるものについて知ったときは、これを知った日から30日以内にその旨を実施医療機関の管理者に報告した上で、委員会にご報告ください。当該臨床研究実施者は、委員会の意見を尊重して必要な措置をとる必要があります。
提出するもの
医療機器の臨床研究の不具合報告の場合
- 医療機器疾病等又は不具合報告書【統一書式9】
※審査申請システムの入力フォームから自動作成。書式添付も可。 - 詳細記載用書式
- 疾病等報告書(医療機器)【別紙様式第2-2】
※jRCT上で作成し、一時保存したデータ(PDFファイル)を提出してください。
再生医療等製品の臨床研究の不具合報告の場合
- 再生医療等製品疾病又は不具合報告書【統一書式10】
※審査申請システムの入力フォームから自動作成。書式添付も可。 - 詳細記載用書式

統括管理者は、当該臨床研究が臨床研究法又は研究計画書に適合していない状態を知ったときは、実施医療機関の管理者に報告する必要があります。特に重大な不適合が判明した場合においては、委員会にご報告ください。
等をいう。ただし、臨床研究の対象者の緊急の危険を回避するためその他医療上やむを得ない理由により研究計画書に従わなかったものは含まない。)
不適合とは
規則、研究計画書、手順書等の不遵守及び研究データの改ざん、ねつ造等重大な不適合とは
当該臨床研究の対象者の人権や安全性及び研究の進捗や薬価の信頼性に影響を及ぼすもの(選択・除外基準や中止基準、併用療法等の不遵守等をいう。ただし、臨床研究の対象者の緊急の危険を回避するためその他医療上やむを得ない理由により研究計画書に従わなかったものは含まない。)
提出するもの
- 重大な不適合報告書【統一書式7】
※審査申請システムの入力フォームから自動作成。書式添付も可。
中止報告
統括管理者は、当該臨床研究を中止する場合には、委員会にご報告ください。| 対応内容 | |
| 1 | 統括管理者は、特定臨床研究推進センターに次の書類を提出し、委員会の意見を聴いてください。
□ 中止通知書【統一書式11】※審査申請システムの入力フォームから自動作成されます。書式添付も可。 □ 特定臨床研究中止届書【省令様式第4】 ※jRCT上で作成し、一時保存したデータ(PDFファイル)を提出してください。 |
| 2 | jRCTにて、特定臨床研究中止届書【省令様式第4】を公表し、原本を関東信越厚生局に提出してください。 |
| 3 | 中止届を提出し対象者の措置を終えた場合においては、中止した日またはすべての評価項目に係るデータの収集を行うための期間が終了した日のいずれか遅い日から原則1年以内に「終了報告」の手続きを行ってください。 |
- 疾病等報告、定期報告等
- 臨床研究の進捗状況に関する事項の変更に該当する場合には、実施計画の変更の届出
終了報告
統括管理者は、以下をそれぞれ作成し、委員会の意見を聴いたうえで厚生労働大臣へ報告してください。※主要評価項目報告書の作成を行う場合は、実施計画を変更することにより行ってください。
- 主要評価項目報告書(期日:主要評価項目データの収集期間が終了した日から1年以内)
- 総括報告書および総括報告書の概要(期日:全てのデータの収集期間が終了した日から1年以内)
| 対応内容 | |
| 1 | 統括管理者は、特定臨床研究推進センターに次の書類をご提出ください。委員会にて審査を行います。
□ 終了通知書【統一書式12】 ※審査申請システムの入力フォームから自動作成されます。書式添付も可。 □ 総括報告書 □ 総括報告書概要(終了届書【別紙様式1】)※jRCT上で作成し、一時保存したデータ(PDFファイル)を提出してください。 |
| 2 | 委員会からの審査結果通知書を受領した1ヶ月以内に、臨床研究等提出・公開システム(jRCT)にて、主要評価項目報告書または総括報告書の概要をご公表ください。 |
| 3 | 統括管理者の概要・総括報告書を実施医療機関の管理者へご提出ください。 |
| 4 | 関東信越厚生局に次の書類を提出してください。
□ 総括報告書の概要(終了届書【別紙様式1】) □ 研究計画書(最終の説明文書を含む) □ 統計解析計画書(作成した場合に限る) |
| 5 |
|