関係者の方

関係者の方へ
医師主導の治験
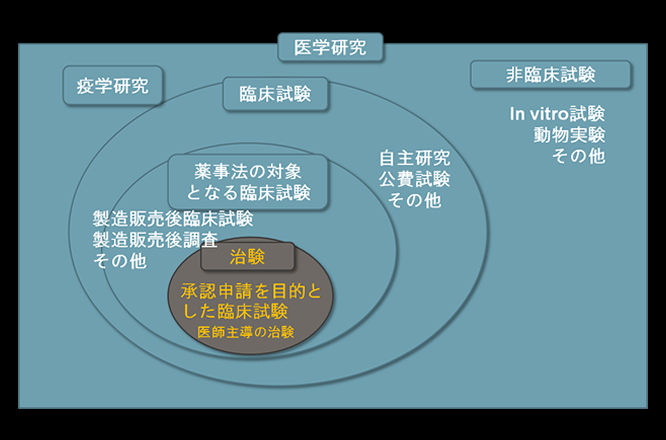
医学研究には、その手法や目的に応じて様々な分類、名称で呼ばれる研究の種類があります。薬物や医療機器の治療効果を見るための研究は、臨床試験(clinical trial)(または、介入研究(intrervension study))と呼ばれます。製造販売後臨床試験と併せて、企業により行われるものは企業主導臨床試験とされます。この試験の実施にあたっては、GCP(Good Clinical Practice、臨床試験の実施の基準に関する省令)が適応され、厳しい基準を遵守して実施する事が義務づけれています。
それ以外のものは、研究者(あるいは医師)が自ら研究計画を主導した臨床試験となります。さらにその中でも、平成15年に薬事法が改正され、医師による承認申請を目的とした臨床試験が可能となり、医師主導治験と呼ばれ、企業主導と同様にGCPを遵守した実施が求められる試験が平成16年からスタートしました。
それ以外のものは、研究者(あるいは医師)が自ら研究計画を主導した臨床試験となります。さらにその中でも、平成15年に薬事法が改正され、医師による承認申請を目的とした臨床試験が可能となり、医師主導治験と呼ばれ、企業主導と同様にGCPを遵守した実施が求められる試験が平成16年からスタートしました。
書式ダウンロード
こちらから標準業務手順書や当院書式のダウンロードが可能です。
手順書等ダウンロード
| 書類名 | ダウンロード |
| 医師主導治験 医療機器 業務手順書(第1.0版 2013年11月19日) | |
| 医師主導治験 医療機器 治験委員会手順書 (第1.0版 2013年11月19日) | |
| 医師主導治験 医療機器 統一書式 | word |
埼玉医科大学様式ダウンロード
| 書類名 | ダウンロード |
| ①契約書1-二者(2008年6月17日改訂) | word |
| ①契約書2-三者(2008年6月17日改訂) | word |
| ②覚書(治験費用等)(2008年9月9日改訂) | word |
| ③入金申込書 | word |
| ④医療機器受託治験(中央検査部用) | word |
| ⑤有害事象(治験責任医師のコメント)報告用紙 | word |
| ⑥治験コ-ディネ-タ-協力依頼書 | word |
| ⑦治験コ-ディネ-タ-協力依頼承諾書 | word |
| ⑨モニタリング 監査結果報告書 | word |
| ⑩治験機器 管理者指名書(2008年9月9日改訂) | word |
| 参考-3(契約内容変更用覚書) | word |