研究代表(責任)医師は、疾病等が発生した場合の手順書に沿った対応を行ってください。
そして、臨床研究の実施に起因するものと疑われる疾病等が発生した場合は、当該臨床研究の中止その他の必要な措置を講じる必要が
あります。
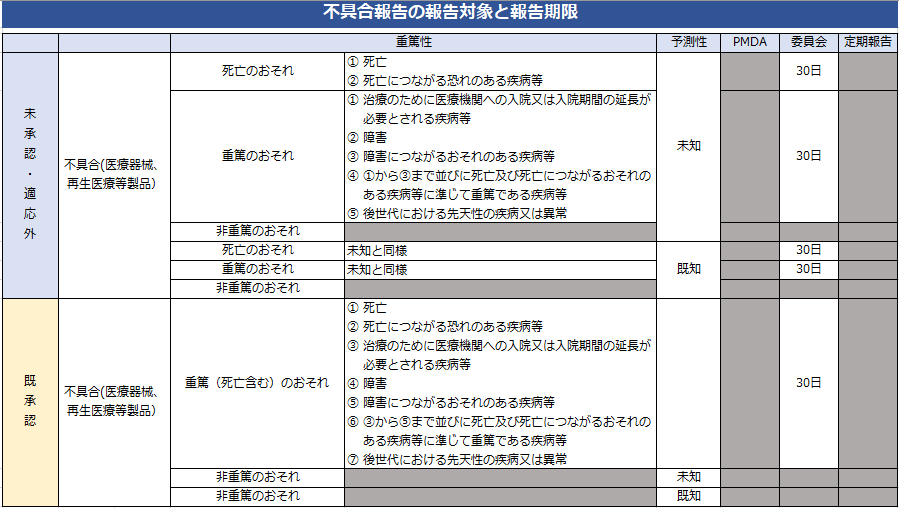
① 当該臨床研究を実施する研究責任医師は、当該臨床研究の実施について、下表に基づき、それまでに判明している範囲で報告期間内に
第1報を報告する。
※その後速やかに詳細な要因等について続報として報告を行うこととし、当該続報については必ずしも期間内でなくても差し支えない。
② それぞれに定める期間内に実施医療機関の管理者に報告した上で、委員会に報告する。
※状況に応じて報告の順番が前後するのは差し支えない。なお、これらの報告と同時に被験薬の製造販売をし、又はしようとする医薬品
等製造販売業者にも情報提供を行う。
③ 当該臨床研究実施者は、委員会の意見を尊重して必要な措置をとる。
- 提出するもの
- 医薬品の疾病等報告書【統一書式8】 ※審査申請システムの入力フォームから自動作成。書式添付も可。
- 詳細記載用書式
- 疾病等報告書(医薬品)【別紙様式第2-1】※未承認・適応外医薬品等の予期できない死亡または重篤な疾病等の場合
※jRCT上で作成し、一時保存またはPMDA送信後の登録情報から生成した報告用データ(PDFファイル)を提出してください。 - 必要に応じて、検査値等の臨床データの写し
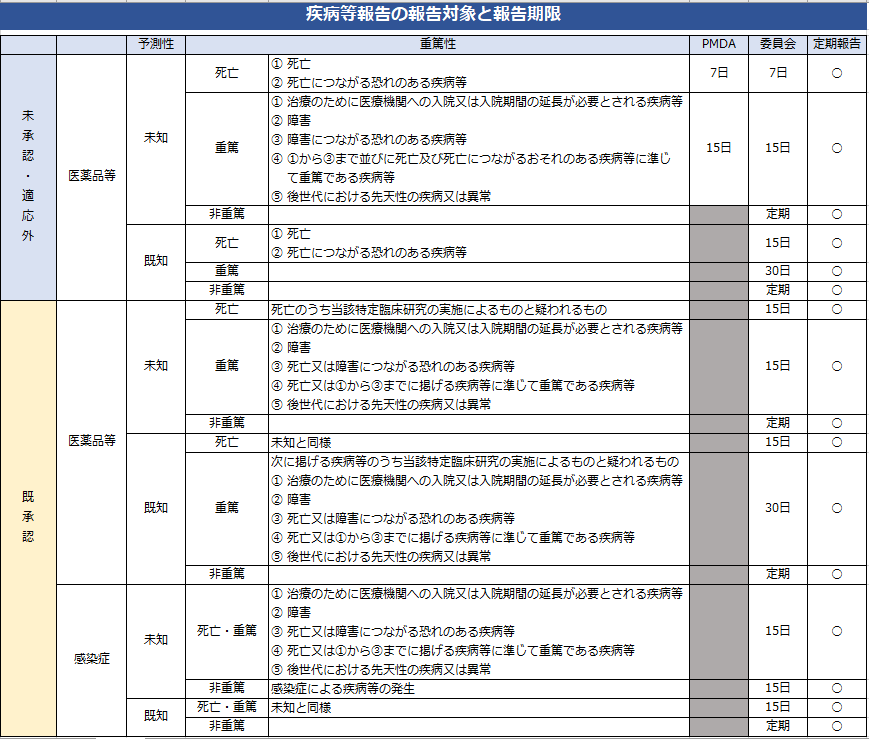
※厚生労働省:「臨床研究法の概要(2020年7月7日)」に掲載されている「疾病等報告の対象研究と報告期限」とは記載が異なりますが、
未承認・適応外の医薬品等における、既知、重篤な疾病等に関して、当委員会では報告期限を「30日」と規定します。